読んだ後に学びがあったと感じた方は、♡をタップしていただけると嬉しいです。
分子の形は、単に原子の数で決まるわけではありません。背後には「電子同士ができるだけ離れようとする性質」があり、それをもとに形が決まっていきます。
ここで少し立ち止まって考えてみましょう。もし電子同士が近くに集まってしまったら、マイナス同士の反発で不安定になりますよね。この“見えない力”が、分子の立体構造を形づくるのです。
分子の形はどうやって決まるのか?
📘 代表的な分子の形
分子の形には、直線形、折れ線形、三角錐形、正四面体形などがあります。
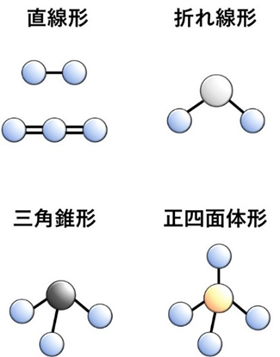
形は、原子の配置だけでなく、共有電子対や非共有電子対の数と種類によっても変わります。
📘 電子対反発則とは
電子対反発則とは、共有電子対どうし、共有電子対と非共有電子対、非共有電子対どうしが、互いに反発してできるだけ離れようとする性質のことです。このルールに沿って、電子対が最も離れる配置をとるように分子の形が決まります。
二重結合や三重結合も、それぞれ1組の電子対(かたまり)として扱います。
実例でわかる分子の形の決まり方
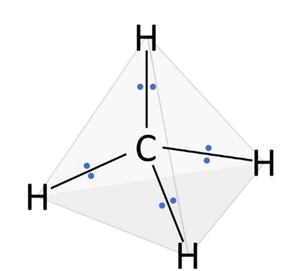
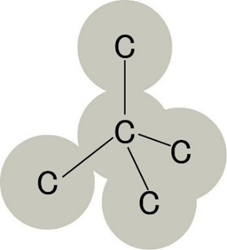
📘 メタン(CH₄)の場合
C原子のまわりに共有電子対が4組あります。電子対が最も離れる配置は正四面体形です。
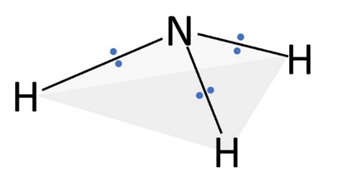
📘 アンモニア(NH₃)の場合
N原子のまわりに「共有電子対3組・非共有電子対1組」があります。正四面体を基盤としつつ、原子配置は三角錐形になります。
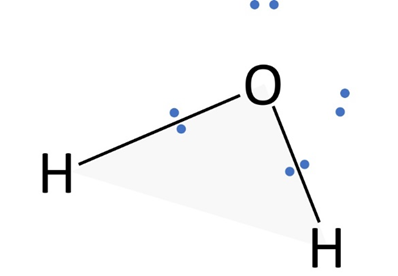
📘 水(H₂O)の場合
O原子のまわりに「共有電子対2組・非共有電子対2組」があります。全体配置は正四面体ですが、水素原子が2つだけなので折れ線形になります。
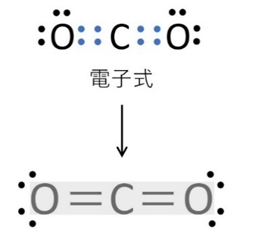
📘 二酸化炭素(CO₂)の場合
C原子を中心に、O原子との間に二重結合が2本。共有電子対2組なので一直線に並び、直線形になります。
まとめと次のステップへ
分子の形は、原子同士の結合だけでなく、電子対同士の反発によって決まります。電子対反発則を意識すれば、初めて見る分子でも形を予測できるようになります。
あわせて読みたい
前の記事>>
次の記事>>
完全版は電子書籍へ
今回紹介したのは、電子書籍『一問一答 理論化学1』のほんの一部です。本書では、分子の形や結合の種類、モル計算など、高校化学の重要ポイントを「しくみから」理解できるように解説しています。しくみがわかると、暗記がラクになり、テストの得点力もぐんと上がります。
続きは電子書籍で、あなたの化学力をさらにアップさせましょう。

この記事、どう感じましたか? 感想もらえると嬉しいです(^^)