読んだ後に学びがあったと感じた方は、♡をタップしていただけると嬉しいです。
液体や固体の分子は、ただ隣り合っているだけではありません。実は「見えない引力」で引き寄せ合っています。これが分子間力です。今日は、その中でも重要な2種類、「ファンデルワールス力」と「水素結合」を押さえていきましょう。
分子間力とは何か?
📘 ファンデルワールス力のしくみ
ファンデルワールス力は、分子間に働く弱い引力です。分子が電気的に中性でも、電子は常に動き回っていて、瞬間的に偏りが生じます。この偏りが隣の分子にも影響し、一時的な電荷のゆがみが生まれ、わずかな静電気的引力が発生します。
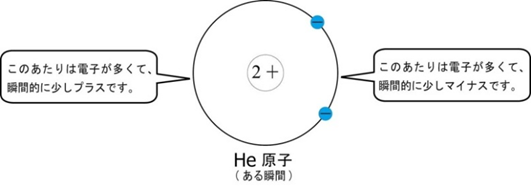
📘 分子量と沸点の関係
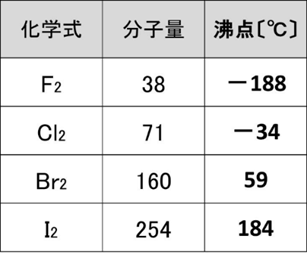
分子量が大きいほど電子の数が多くなり、瞬間的な偏りが起こりやすくなります。その結果、ファンデルワールス力が強まり、分子を引き離すのに必要なエネルギーも増えます。つまり、分子量が大きい分子ほど沸点は高くなる傾向があります。
例としてハロゲン分子(F₂、Cl₂、Br₂、I₂)は、分子量が増えるにつれて沸点が上昇します。ただし、同じ分子量でも極性分子の方が沸点は高めです(HClはF₂より高い)。
📘 水素結合がもたらす特別な性質
水素結合は、F・O・Nなど電気陰性度の非常に大きい原子と水素原子の間に生じる、比較的強い分子間力です。HF、H₂O、NH₃などが代表例で、ファンデルワールス力より約10倍強く、共有結合の約1/10の強さを持ちます。
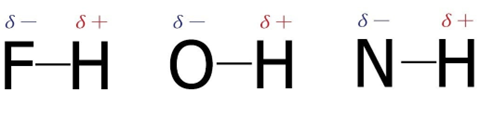
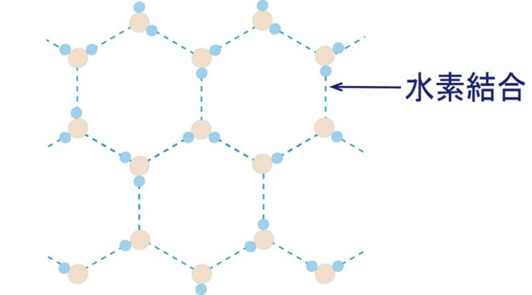
水の「異常」なふるまい
水は氷になると、水素結合で「すき間の多い立体構造」をつくるため、密度が小さくなります。そのため氷は水に浮きます。さらに、氷を加熱して水になるとき、すき間構造が壊れて密度が最大になるのは4℃。これが「水の最大密度は4℃」という特異な性質です。また、H₂O、NH₃、HFは分子量の割に沸点が非常に高く、これも強い水素結合の証拠です。
まとめと学習のステップアップ
- ファンデルワールス力:瞬間的な電子の偏りによる弱い引力
- 水素結合:F・O・NとHの間にできる強い分子間力
- 水は水素結合のおかげで、氷が浮く・沸点が高いなど特異な性質をもつ
分子間力を理解すると、物質の沸点や状態変化の理由がスッキリ見えてきます。
前の単元↓

次の単元↓

さらに詳しい例や演習は、電子書籍『一問一答 理論化学1』で確認できます。あなたの化学理解を一歩深めましょう。
この記事、どう感じましたか? 感想もらえると嬉しいです(^^)