読んだ後に学びがあったと感じた方は、♡をタップしていただけると嬉しいです。
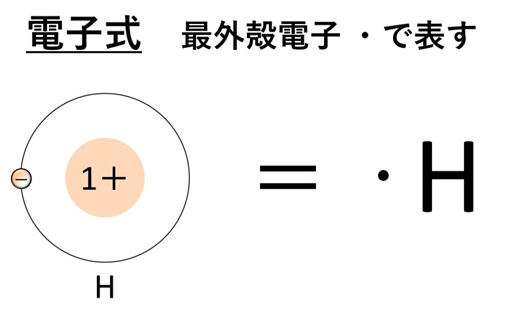
電子式
電子式は、原子の最外殻電子の配置を点(・)で表した図です。点は元素記号の上下左右に分けて置くのが基本です。
📘 点の置き方と窒素原子の例
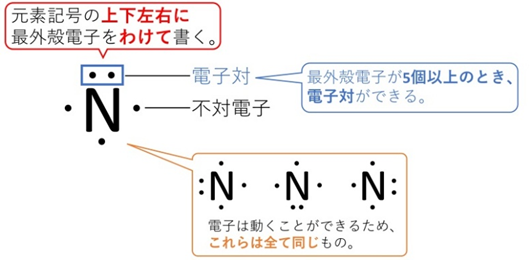
たとえば窒素(N)の場合、原子番号は7なので電子は7個。電子配置はK²L⁵。最外殻電子は5個なので、点を5つ置きます。
📘 不対電子と電子対の意味
電子はペアになると「電子対」、1つだけなら「不対電子」と呼びます。不対電子どうしは結合に使われることが多く、ペアになった電子のうち、他の原子と共有するものを「共有電子対」、共有しないものを「非共有電子対」といいます。
📘 水素分子・水分子・塩素分子の電子式
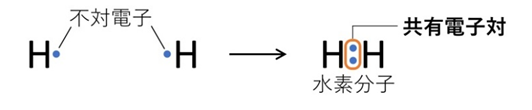
【例1:水素分子 H₂】
各H原子は不対電子を1個もち、それを出し合って1組の共有電子対を作ります。
【例2:水分子 H₂O】
O原子は不対電子を2個もち、H原子は不対電子を1個ずつ持つため、OとHの間に共有電子対が2組できます。残る2組は非共有電子対です。→ 水分子は「共有電子対2組・非共有電子対2組」
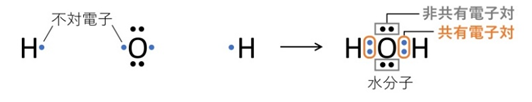
📘 共有電子対と非共有電子対の区別
共有電子対は分子を構成する原子間で共有され、化学結合の本質を担います。一方、非共有電子対は結合には直接関与せず、分子の形や極性に影響を与えます。
構造式
📘 単結合・二重結合・三重結合の違い
共有電子対を1本の線(-)で表したものが構造式です。
・1組の共有電子対 → 単結合(-)
・2組の共有電子対 → 二重結合(=)
・3組の共有電子対 → 三重結合(≡)
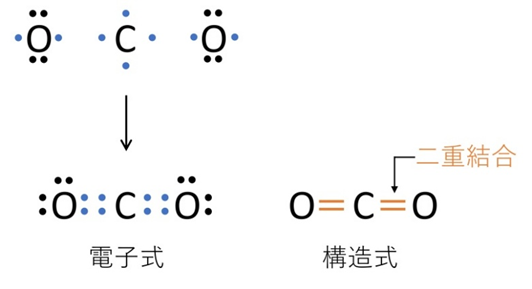
📘 塩化水素・二酸化炭素・窒素分子の構造式
【例:塩化水素 HCl】
HとClの間に単結合1本 → H-Cl

【例:二酸化炭素 CO₂】
Cは不対電子4個、Oは不対電子2個ずつ。CとOの間に二重結合が2本 → O=C=O
【例:窒素分子 N₂】
N原子どうしが3組の共有電子対をつくり、三重結合 → N≡N
まとめ:電子の並び方が分子の形を決める
電子式は、原子の外側にどんな電子があるかを「見える化」する道具です。構造式は、その電子がどう共有されているかを「線」で表したものです。この2つを理解すれば、分子の形や性質がぐっと分かりやすくなります。
もっと演習で身につけたい場合は、電子書籍『一問一答 理論化学1』で練習問題を解きながら覚えるのがおすすめです。電子式から分子の形まで、イメージで定着させられます。

この記事、どう感じましたか? 感想もらえると嬉しいです(^^)