読んだ後に学びがあったと感じた方は、♡をタップしていただけると嬉しいです。
目次
イオン結合とは?
📘 金属と非金属が出会うとき
金属元素は陽イオンになりやすく、非金属元素は陰イオンになりやすい性質があります。例:ナトリウム(Na)→ Na⁺、塩素(Cl)→ Cl⁻。ただし、水素(H)は非金属ですが、H⁺になる点に注意です。
📘 イオン結晶の規則的な並び方
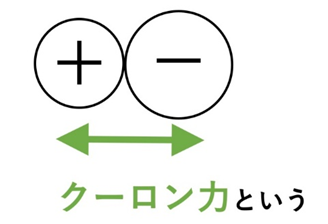
陽イオンと陰イオンは静電気的な引力(クーロン力)で強く引き合い、方向性のない力で多数のイオンが規則正しく並びます。これが「イオン結合」です。
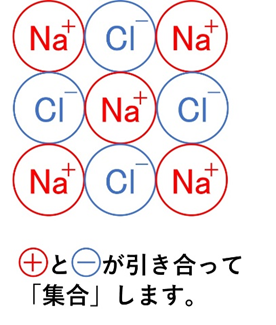
組成式の決まり方
📘 電気的中性になるようにする
イオン結合でできた物質は、「構成イオンの種類と数の比」を表す組成式で示されます。原則は電気的中性で、陽イオンの正電荷と陰イオンの負電荷の合計が0になるように組み合わせます。

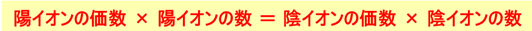
📘 代表的な組成式の例
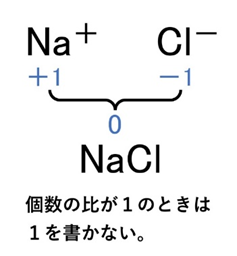
- NaCl → Na⁺(+1)とCl⁻(−1)が1:1
- CaCl₂ → Ca²⁺(+2)とCl⁻(−1)が1:2
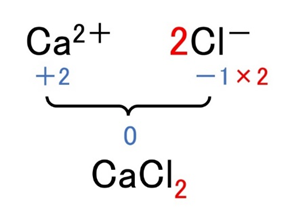
- Ca(OH)₂ → Ca²⁺とOH⁻が1:2
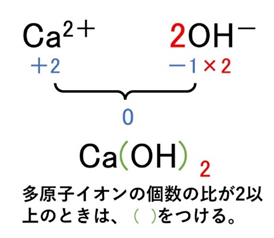
イオン結晶の性質
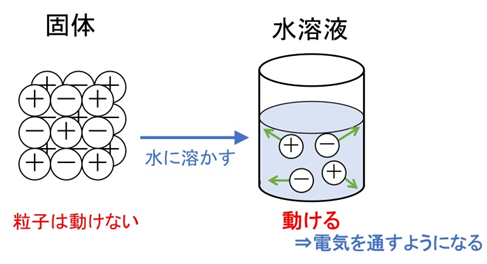
📘 固体と液体で変わる電気伝導性
固体のイオン結晶は電気を通しません。なぜなら、イオンが固定されて動けないからです。しかし、融解したり水に溶かしたりすると、イオンが自由に動き、電気を通すようになります。
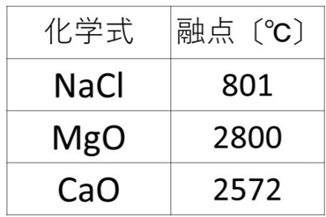
📘 融点を左右する2つのポイント
- 価数の積が大きいほど結合は強く、融点は高い
例:NaCl(1×1=1)よりMgO(2×2=4)の方が融点が高い。 - イオン間距離が短いほど結合は強く、融点は高い
例:Mg²⁺はCa²⁺より小さいため、MgOの方が融点が高い。
まとめと学びのつなぎ
イオン結合は「電荷のバランス」と「イオン間の距離」がすべてのカギです。組成式を正しく書ければ、物質の性質や融点の高さまで予測できるようになります。
この続きでは、共有結合や分子間力と比較し、物質ごとの特徴を見ていきます。詳しい解説と練習問題は電子書籍『一問一答 理論化学1』でチェックしてください。
前の単元↓
次の単元↓

この記事、どう感じましたか? 感想もらえると嬉しいです(^^)