読んだ後に学びがあったと感じた方は、♡をタップしていただけると嬉しいです。
原子の大きさはどう決まる?
原子の大きさやイオンの半径は、周期表の位置や電子配置で決まります。
ただの暗記ではなく、「なぜそうなるのか」を理解すると、覚えるのがずっと楽になります。
今日は、その基本ルールを一気に整理していきましょう。
📘 同じ族で比べたときの変化
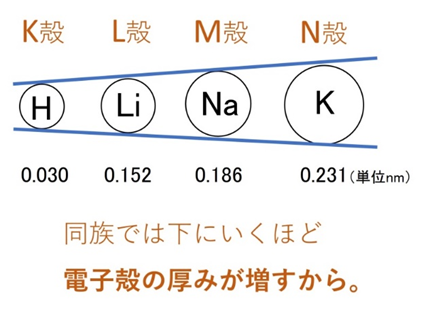
同じ族(縦方向)で比べると、下に行くほど電子殻が増え、原子半径は大きくなります。
例:H(K殻) → Li(L殻) → Na(M殻)
📘 同じ周期で比べたときの変化
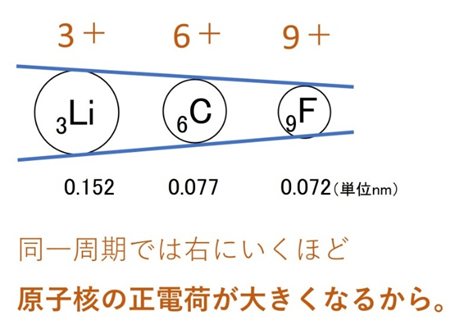
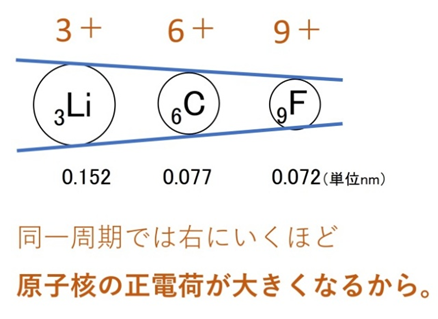
同じ周期(横方向)では、右に行くほど陽子数が増えて引力が強まり、電子が原子核に引き寄せられます。結果、原子半径は小さくなります。例:Li、C、O(すべてL殻まで) → Oの方が小さい。
イオンになると大きさはどう変わる?
📘 陽イオンはなぜ小さくなる?
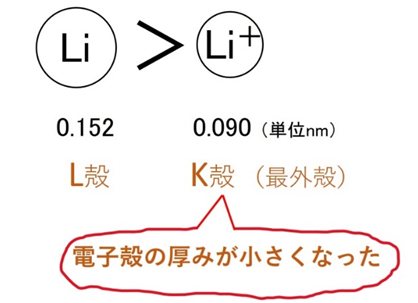
陽イオンになると、最外殻電子を失い電子殻の数が減ります。そのため半径は小さくなります。例:Li(0.152 nm)→ Li⁺(0.090 nm)
📘 陰イオンはなぜ大きくなる?
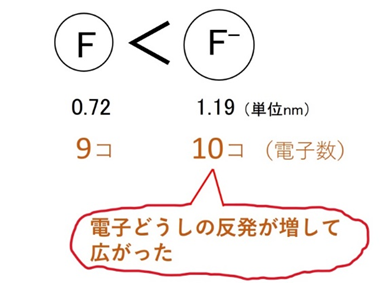
陰イオンになると、電子が増えて電子間の反発が強まり、分布が広がります。結果、半径は大きくなります。例:F(0.72 nm)→ F⁻(1.19 nm)
📘 同じ族でイオン半径を比べる
同じ族では、原子番号が大きくなるほど電子殻が増え、イオンも大きくなります。例(1族):Li⁺(0.090 nm)→ Na⁺(0.116 nm)→ K⁺(0.152 nm)
📘 同じ電子配置で比べると?
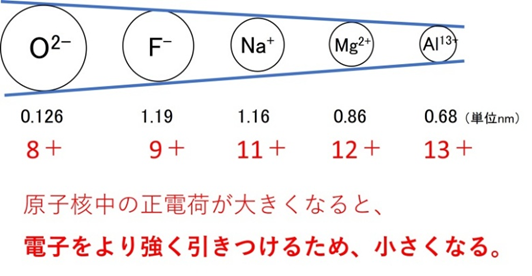
同じ電子数でも、陽子が多いほど電子は強く引き寄せられ、半径は小さくなります。例:O²⁻(1.26 Å) > F⁻(1.19 Å) > Na⁺(1.16 Å) > Mg²⁺(0.86 Å) > Al³⁺(0.68 Å)
電子親和力と原子の性質
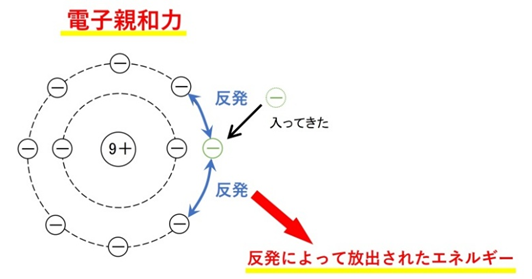
📘 電子親和力とは何か
原子が電子を1個受け取って陰イオンになるときに放出されるエネルギーのことです。
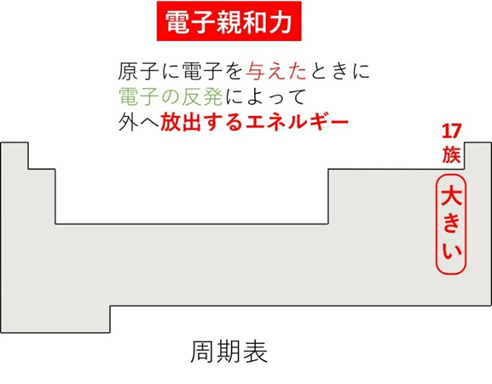
📘 電子親和力が大きい元素とその理由
フッ素(K²L⁷)は、あと1個電子を加えるとL殻が満杯になり安定します。このとき大きな電子親和力を持ちます。特に17族(F, Cl, Br, I)は電子親和力が大きいです。
まとめと次へのステップ
原子やイオンの大きさの変化は、電子殻の数・陽子数・電子間反発という3つの視点で説明できます。この仕組みを理解しておけば、周期表を見ただけで大きさの傾向を予測できるようになります。
次のステップでは、この「大きさのルール」が化学結合や物質の性質にどう影響するかを見ていきましょう。
前の単元↓

次の単元↓

本記事は電子書籍『一問一答 理論化学1』で詳しく解説しています。理解編の図解と練習問題で、今回の内容をさらに確実にしましょう。
この記事、どう感じましたか? 感想もらえると嬉しいです(^^)