- 化学反応式を「係数比=モル比」として整理する基本の考え方
- mol計算の3ステップ(数値→mol→比→計算)の流れ
- 質量(g)、体積(L)をmolに変換する方法
- 過不足計算のときに「どちらが余るか」を見極めるコツ
- 実際の入試・定期テスト頻出パターン(例題1〜4)の解き方
読んだ後に学びがあったと感じた方は、♡をタップしていただけると嬉しいです。
【基本のやり方】3つのステップでマスターする。
化学反応式の計算って、どこから手をつけたらいいの?
そんなあなたに向けて、「係数比=モル比」を出発点としたモル計算の3ステップをわかりやすく紹介します。
次の例題で、化学反応式とモル計算の基本練習を見てみましょう。
CH4 2molが反応すると、H2Oは何mol生成するか?
CH4+2O2→CO2+2H2O
📘ステップ①:「数値」と「単位」を反応式の下に書き込む
まずは問題文から与えられた数値と単位を、反応式の物質の下に書き込みましょう。
📘ステップ②:与えられた量をmolに変換する
質量(g)が与えられていれば、分子量や原子量で割ってmolに変換。
体積(L)が与えられていれば、22.4で割るとmolになります(標準状態)。
📘反応式の係数比(=モル比)で他の物質のmolを求める
あとは、反応式の係数を読み取り、計算すればOKです。
- CH4 2molが反応すると、H2Oは何mol生成するか?
-
2〔mol〕×2=4〔mol〕
1CH4+2O2→CO2+2H2O
CH4 とH2Oの係数比は1:2より、モル比も1:2になります。CH4 1molが反応すれば、H2Oは2mol生成します。
【 質量g ⇔ mol 】の変換に慣れる
H₂ 6.0gが反応すると、H₂Oは何g生成するか? 分子量:H₂=2.0、H₂O=18
2H₂ + O₂ → 2H₂O
解答 6.0 ÷ 2.0 = 3.0〔mol〕 3.0 × 18 = 54〔g〕
解説
反応式より、H2 とH2Oの係数比は2:2より、モル比も2:2になります。H₂ 2molからH₂O 2molが生成されます。
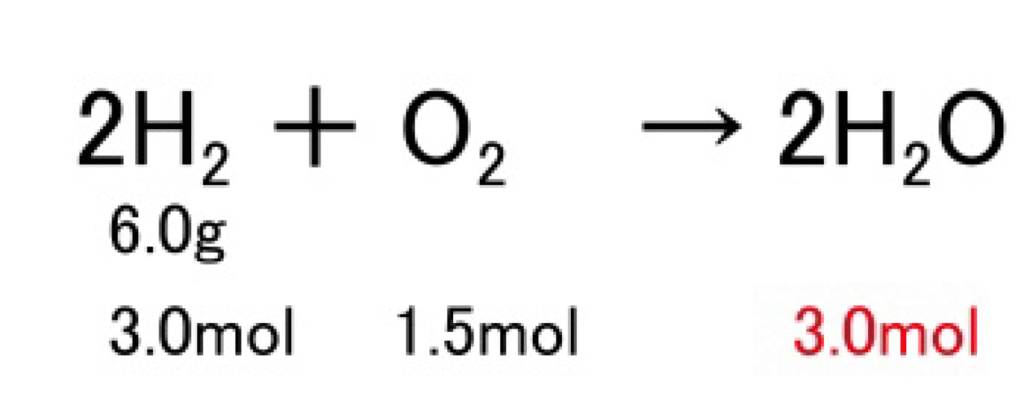
したがって、H₂ 3.0molからはH₂O 3.0molができることになります。求める質量は、 3.0〔mol〕 × 18〔g/mol〕= 54〔g〕
【体積比=モル比】気体の体積の計算はコレを使う
N₂ 5.6LとH₂を触媒のもとで反応させて、NH₃を生成した。H₂は何L反応したか?
N₂ + 3H₂ → 2NH3
解答 0.25×3×22.4=16.8〔L〕
解説
この反応では、係数比が1:3:2です。したがって、モル比・体積比もすべて1:3:2です。
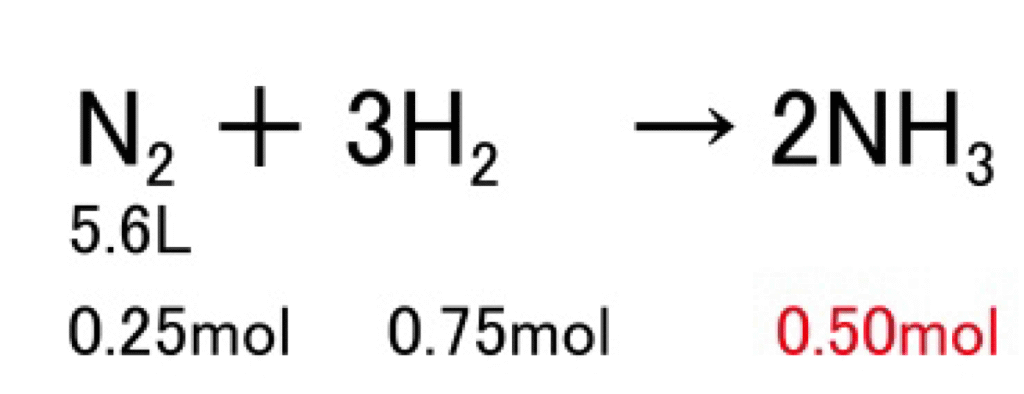
- N₂ 1molとH₂ 3molから、NH₃は2mol生成
- N₂は5.6L → molに直すと 0.25mol
- よって、H₂は 0.25mol × 3 = 0.75mol
体積に戻すと、0.75mol × 22.4L = 16.8L
【過不足の計算】反応が止まるタイミングを考える
エチレンC2H4 2.8gに標準状態(0℃、1気圧)で3.36Lの酸素O2を混合し、この混合気体に点火したところ、どちらかの気体の一部が未反応のまま残った。①エチレンと酸素のどちらが残ったか。②生じた水は何gか。 分子量:C2H4=28、H2O=18
C2H4 + 3O₂ → 2CO2 + 2H2O
解答 ① 残った気体は、エチレンC₂H₄ ② 1.8〔g〕
解説
まず、与えられた気体の物質量molを求めます。
・C₂H₄:2.8 ÷ 28 = 0.10〔mol〕
・O₂:3.36 ÷ 22.4 = 0.15〔mol〕
この反応では、C₂H₄とO₂の係数比(=モル比)は1:3です。
【仮説1】 エチレンがすべて反応した場合
C₂H₄ 0.10mol をすべて反応させるには、O₂が 0.10mol × 3 = 0.30mol必要です。
しかし、O₂は 0.15mol しかありません。よって、O₂が不足しており、C₂H₄全量が反応することは不可能です。
【仮説2】 酸素がすべて反応した場合
O₂ 0.15mol がすべて反応すると考えると、C₂H₄は 0.15mol ÷ 3 = 0.050molだけ反応することになります。
このとき、もともとのC₂H₄ 0.10molのうち、0.10mol − 0.050mol = 0.050mol が未反応で残ることになります。したがって、① 残った気体は、エチレン(C₂H₄) です。
この反応では、C₂H₄とH₂Oの係数比(=モル比)は1:2です。今回は、C₂H₄ 0.050mol が反応しているので、H₂O は 0.050mol × 2 = 0.10mol

(本反応のまとめ)
よって、求める水H2Oは、0.10×18=1.8〔g〕
ステップ①
文中に与えられた「数値」と「単位」を、反応式の下に書き込む。
ステップ②
与えられた量をmolに変換する。変換したら、次の3段階で整理する:
前(反応前):反応前にあるmol
反応(反応量):実際に反応に使われたmol
後(反応後):反応が終わった後に残るmol
この3つを並べて書くことで、どの物質が余り、どの物質が使い切られたかが一目で分かるようになります。
ステップ③
どちらが少ないかを見極め、「反応が止まるタイミング」を決める。
ここでは、「少ない方が先になくなる=反応がそこで止まる」ことに着目します。そして、反応式の係数比=モル比を用いて、他の物質のmolを求めます。
これまでの計算に共通するポイント!
「数値」と「単位」を反応式の下に書き込む
与えられた量をmolに変換する
反応式の係数比(=モル比)で他の物質のmolを求める
前の単元↓

次の単元↓

この記事、どう感じましたか? 感想もらえると嬉しいです(^^)