- 「濃度」とは何を表す量なのかを理解できる
- 溶質・溶媒・溶液の違いを区別できる
- 質量パーセント濃度の意味と計算方法を整理できる
- モル濃度の意味と計算式を理解できる
- 濃度を「質量ベース」と「体積+物質量ベース」の2つの視点で整理できる
読んだ後に学びがあったと感じた方は、♡をタップしていただけると嬉しいです。
目次
濃度の基本をマスターしよう
「濃度8%」「0.5 mol/L」…化学でよく出てくるこの表現、意味がぼんやりしていると計算問題でつまずきがちです。
今回は、その入口として
- 濃度とは何か
- 溶質・溶媒・溶液の違い
- 質量パーセント濃度とモル濃度の基礎
を、図解とともに確認していきましょう。
📘まずは「溶質・溶媒・溶液」を整理します
溶質…溶けているもの(例:食塩)
溶媒…溶かしているもの(例:水)
溶液…溶質と溶媒が混ざった全体(例:食塩水)
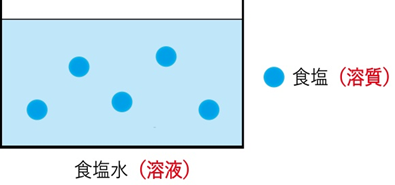
【図】 食塩水で溶質と溶液を考えてみる
質量パーセント濃度とは?
質量パーセント濃度は、「溶液全体の質量に対して、溶質が何g含まれているか」を表す濃度です。ポイントは 必ず質量(g)で統一すること。体積(mL)で計算しないよう注意します。
分母は溶液全体の質量。溶媒の質量ではありません。
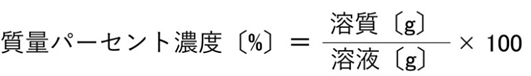
【図】 質量パーセント濃度の計算式
✔ 分母は溶液全体
✔ 単位はすべてg(グラム)
✔ 日常的な例(食塩水など)でも使われる
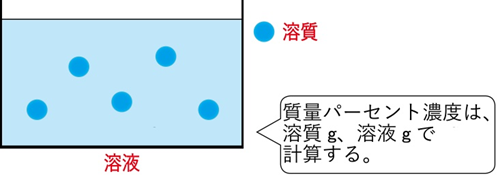
【図】 質量パーセント濃度の考え方
モル濃度とは?
モル濃度は、「溶液1Lあたりに溶質が何mol含まれているか」を表す濃度です。
質量パーセント濃度と異なり、体積(L)と物質量(mol)を使います。
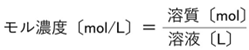
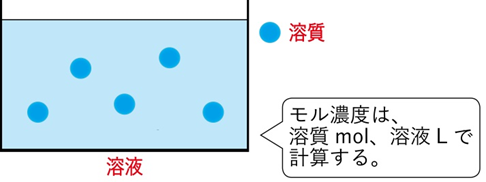
✔ モル濃度=mol ÷ L
✔ 体積と物質量で計算する
✔ 常に「1Lあたり」で考える
今回のまとめ
- 溶質・溶媒・溶液の違いを理解する
- 質量パーセント濃度は、質量gで考える。
- モル濃度は、体積Lと物質量molで考える。
これで濃度の基本的な立ち位置が見えてきたはずです。
前の単元↓
あわせて読みたい


【体系解説】化学反応式とモル計算のやり方
この記事を読んでわかること 化学反応式を「係数比=モル比」として整理する基本の考え方 mol計算の3ステップ(数値→mol→比→計算)の流れ 質量(g)、体積(L)をmolに…
次の単元↓
あわせて読みたい


【体系解説】濃度変換の計算
この記事を読んでわかること 濃度計算が「4つの型」で整理できることが理解できる。 g・mol・L の変換ルートを使った式の立て方が身につく。 モル濃度と質量パーセント…
この記事、どう感じましたか? 感想もらえると嬉しいです(^^)