この記事を読んでわかること
- 濃度計算が「4つの型」で整理できることが理解できる。
- g・mol・L の変換ルートを使った式の立て方が身につく。
- モル濃度と質量パーセント濃度の違いと計算方法を区別できる。
- 希釈・混合の問題で「変わらない量」を基準に解けるようになる。
- 例題を通して「型どおりに進めればシンプルに解ける」実感が得られる。
読んだ後に学びがあったと感じた方は、♡をタップしていただけると嬉しいです。
濃度計算はこの4タイプだけ── 型を覚えれば迷わない。
濃度計算が苦手な理由の多くは、「与えられた数値をどう使えばいいか」が見えないからです。
しかし実際には、4つの型を押さえれば解法の道筋がはっきりします。
濃度計算の基本4タイプ
- 単位を換える計算
- モル濃度の計算
- 質量パーセント濃度の計算
- 希釈・混合の計算
このページでは、「なんとなく計算していた」状態から、「必要な情報をもとに意味のある式を組み立てられる」状態に変わるための最初の一歩を紹介します。
📘単位とモノを見極める!
まずは問題を見たら、「何が与えられていて、何を求めるのか?」を見抜くクセをつけましょう。
たとえば、
溶質の物質量(mol)と溶液の体積(L)が与えられている
→ モル濃度を求めればよい
このように、単位を見て反応するのが第一歩です。
g ⇄ mol ⇄ L の変換は、分子量・密度などを使って自由に行き来できるようになります。
・密度(g/cm3)… 1cm3あたりの質量。例:水は約1.0 g/cm3
📘「濃度計算の型」を図で押さえよう
どの問題も、基本の型を使えばスッと式が立てられます。ここではその全体像を見ておきましょう。
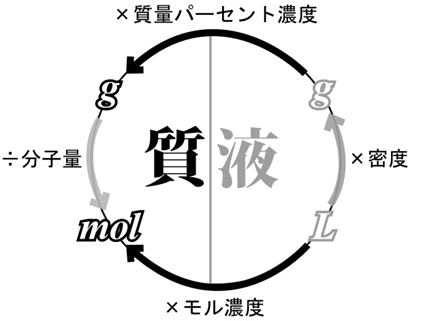
図中の矢印は、質量・物質量・体積の間での変換方法を表します。
前の単元↓

次の単元↓

📘 モル濃度と質量パーセント濃度のちがいは?
どちらも「溶質 ÷ 溶液」の形ですが、割るものの単位がちがいます。
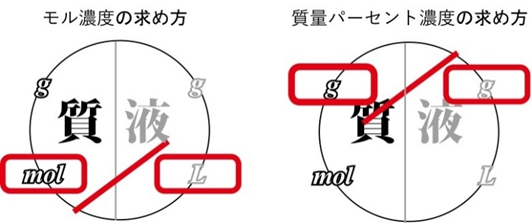
・モル濃度:mol / L(体積ベース)
・質量パーセント濃度:g / g(質量ベース)
濃度は割合です。
「全体に対してどれだけ入っているか」を、体積か質量のどちらで測るかの違いです。
📘希釈・混合では「変わらない量」がカギ!
水でうすめたり、溶液どうしを混ぜる問題では、「変わらないもの」を使って式を立てます。
よく使う『3つの変わらない量』
① 溶質の質量g
② 溶質の物質量mol
③ 混合後の溶液全体の質量g
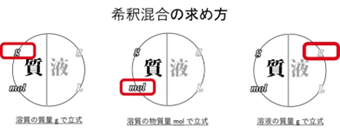
この図では「何を基準にして式を立てるか」を整理しています。薄める前後で変わらない量を見つけられると、どんな問題でもスムーズに式が立てられます。
2.0mol/LのH2SO4水溶液 500mL 中のH2SO4の質量を求めよ。 分子量:H2SO4=98
解答 98 g
解説
1 体積をLに変換 → 0.500 L
2 物質量mol → 0.500 × 2.0 = 1.0 mol
3 質量g → 1.0 × 98 = 98 g
ここで少し立ち止まって考えてみましょう。体積からmol、molからgへと、型の矢印どおりに進めただけです。慣れてしまえば、計算はとてもシンプルです。
濃度計算は型で覚える!まずは図になじもう
・単位とモノをセットで確認する
・モル濃度は mol/L、質量パーセント濃度は g/g
・希釈・混合は「変わらない量」を使う
・式は「型」の矢印に沿って組み立てる
続きは電子書籍で!濃度の問題もスラスラ解けるように
この記事で紹介したのは、第7章のごく一部です。続きでは、
などを扱います。
この記事、どう感じましたか? 感想もらえると嬉しいです(^^)