読んだ後に学びがあったと感じた方は、♡をタップしていただけると嬉しいです。
原子(atom)という言葉は、「これ以上分けられない」という意味のギリシャ語が由来です。昔の人々は、原子が物質を構成する最小単位であり、分けることはできないと考えていました。
しかし、近代の実験によって、原子はさらに小さな粒子からできていることがわかりました。現在では、原子は中心の「原子核」(陽子と中性子)と、そのまわりを動く「電子」で構成されています。
もし原子をサッカースタジアムの大きさにすると、原子核はなんとピンポン玉程度の大きさしかありません。電子はそのはるか外側を回っているのです。
原子は何からできている?
📘原子核と電子の役割
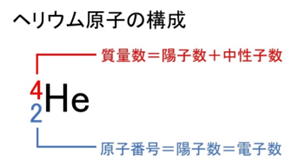
原子番号は「陽子の数」を表します。原子は全体として電気的に中性なので、電子の数も陽子と同じです。
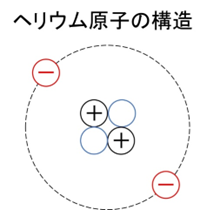
たとえば、ヘリウム(He)は陽子が2個、電子も2個あり、中性子は2個なので質量数は4になります。
電子の質量は陽子や中性子の約1/1840しかなく、原子の質量はほぼ陽子+中性子の合計で決まります。
📘原子番号と質量数のちがい
原子番号は陽子の数、質量数は陽子と中性子の合計数を指します。この区別は元素を理解するうえでとても重要です。
電子殻と電子配置の仕組み
📘電子殻の名前と最大電子数
電子は原子核のまわりにある「電子殻」に配置されます。内側からK殻、L殻、M殻、N殻…と呼ばれ、最大電子数は次の通りです。
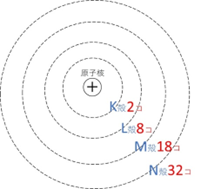
- K殻:2個
- L殻:8個
- M殻:18個
- N殻:32個
映画館の座席のように、電子は内側から順に座っていくイメージです。
電子配置の書き方と例
電子配置とは、電子がどの殻にどれだけ入っているかを示す方法です。
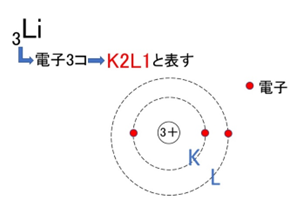
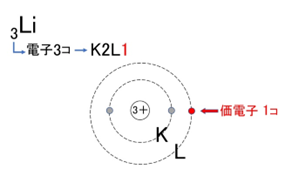
【例1】リチウム(Li):K²L¹
【例2】ナトリウム(Na):K²L⁸M¹
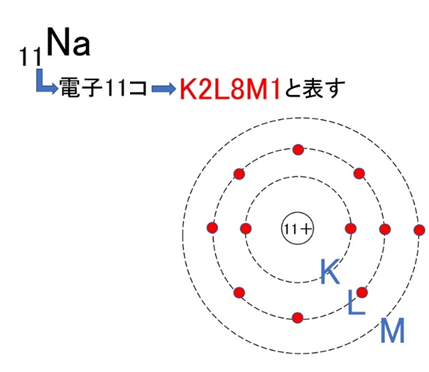
価電子と化学反応のつながり
📘価電子の数え方
最外殻にある電子が「価電子」です。化学反応では、この価電子が大きな役割を果たします。
【例1】リチウム(Li):K²L¹ → 価電子は1個
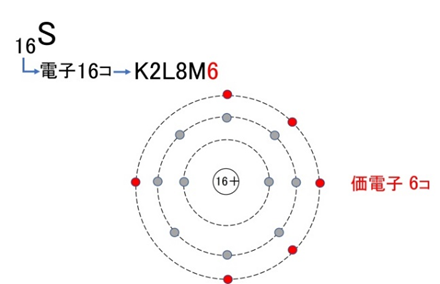
【例2】硫黄(S):K²L⁸M⁶ → 価電子は6個
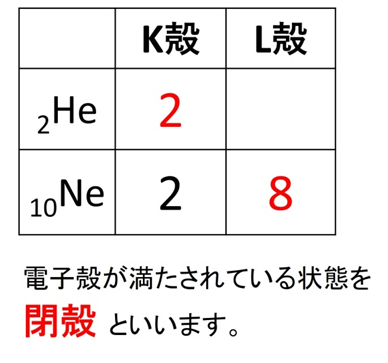
📘貴ガスと安定した電子配置
18族元素(ヘリウム、ネオン、アルゴンなど)は、最外殻電子数がすでに安定しているため、他の原子と結びつきにくく、価電子数は0とみなされます。
まとめ
原子は、中心の原子核とその周囲を回る電子でできています。電子は内側から順に電子殻に配置され、最外殻にある価電子が化学反応のカギを握ります。貴ガスのように安定した電子配置をもつ原子は反応しにくいという特徴も覚えておきましょう。
この続きでは、電子配置と化学結合の関係や、原子同士がどうやって分子を作るのかを詳しく解説しています。もっと深く理解したい方は、電子書籍『一問一答 理論化学1』でじっくり学んでみてください。


この記事、どう感じましたか? 感想もらえると嬉しいです(^^)