読んだ後に学びがあったと感じた方は、♡をタップしていただけると嬉しいです。
目次
金属結晶・金属結合・自由電子
みなさん、身の回りの金属、たとえばスプーンやスマホの筐体が、なぜあんなに丈夫で光っているのか考えたことはありますか?
実はその秘密は、原子レベルでの「並び方」と「電子の動き方」にあります。ここでは、金属結晶と金属結合、そして似ているようで異なる「配位結合」のしくみを見ていきましょう。
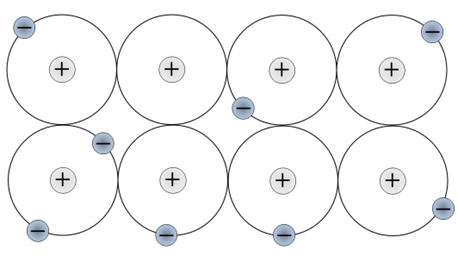
📘 金属結晶とは

金属原子は規則正しく整列し、その中で価電子が結晶全体を自由に動き回っています。この自由に動く電子は「自由電子」と呼ばれ、金属特有の性質を生み出します。
📘 金属結合の正体|陽イオンと自由電子の静電引力
価電子を失って陽イオンになった金属原子と、自由電子との間には静電気的な引力が働きます。これが金属結合です。方向性がなく、全体的に原子を結びつけるため、金属は変形しても壊れにくいのです。
📘 金属の4つの代表的性質
- 金属光沢
磨くと特有の光沢が現れます。これは自由電子による光の反射が原因です。 - 電気・熱伝導性
自由電子が動くため、電気も熱もよく通します。特に銀は最高の伝導性を持っています。 - 展性・延性
たたくと広がる展性、引っ張ると伸びる延性があります。これは原子の位置がずれても結合が保たれるためです。

- 融点の違い
典型元素の金属は比較的低い融点ですが、遷移元素は高い傾向があります。タングステンは約3410℃と非常に高く、水銀は常温で液体です。
配位結合とは?電子対の出どころが鍵
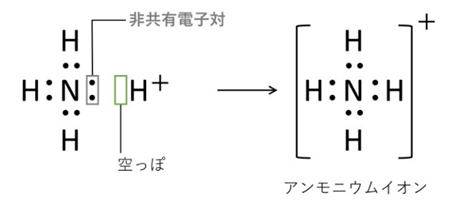
📘 配位結合とは
共有結合との違いは「電子対の出どころ」。配位結合では、一方の原子が持つ非共有電子対を相手に提供して結合します。
【例1】アンモニウムイオン(NH₄⁺)
アンモニア(NH₃)が水素イオンに非共有電子対を渡して結合。
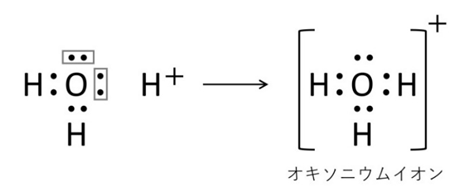
【例2】オキソニウムイオン(H₃O⁺)
水(H₂O)が水素イオンに非共有電子対を渡して結合。
まとめ
金属結晶は「自由電子」のおかげで、強さとしなやかさを両立しています。また、配位結合は電子の提供元が一方に偏るというユニークな特徴を持ちます。これらのしくみを理解すると、身近な物質の性質がグッと身近に感じられますよ。
さらに詳しい図解や演習問題は、電子書籍『一問一答 理論化学1』で解説しています。理解を深めたい方は、ぜひそちらもチェックしてみてください。
あわせて読みたい
前の単元↓
実況!高校化学の勉強法|聴く・読…

【体系解説】硬さと性質の秘密に迫る!共有結合結晶の特徴とダイヤモンド・黒鉛の違い – 実況!高校化学の…
※本ナレーションはAIによるプロ声優の音声を使用しています。 一部の化学用語に誤読が含まれることがありますが、ご了承ください。 今後、全編を最適化した高品質ナレーシ…
次の単元↓
あわせて読みたい


【体系解説】モル計算の基本は3つだけ
※本ナレーションはAIによるプロ声優の音声を使用しています。 一部の化学用語に誤読が含まれることがありますが、ご了承ください。 今後、全編を最適化した高品質ナレー…
この記事、どう感じましたか? 感想もらえると嬉しいです(^^)