読んだ後に学びがあったと感じた方は、♡をタップしていただけると嬉しいです。
分子の極性とは?
「HClは極性分子なのに、CO₂は無極性分子ってどういうこと?」
このあたりでつまずく高校生はとても多いです。
分子の極性は、単に原子の組み合わせだけでなく、「電気陰性度」と「分子の形」の両方が関わっています。今日は、そのポイントを例と図でしっかり押さえていきましょう。
📘 極性分子と無極性分子の見分け方
分子全体として電荷の偏りがある場合、それを「極性分子」といいます。逆に電荷の偏りがない場合は「無極性分子」です。
極性分子の例は HCl、H₂O、NH₃、無極性分子の例は H₂、Cl₂、CO₂ です。
📘 電気陰性度が極性を生むしくみ
電気陰性度とは「共有電子対を引きつける力の強さ」のこと。
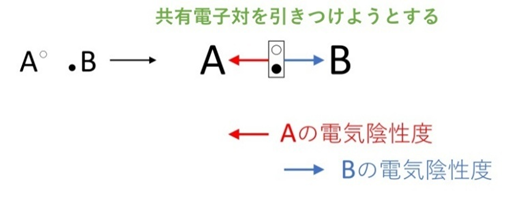
HClのようにHとClの電気陰性度に差があると、共有電子対はCl側に偏ります。これが極性の正体です。
電気陰性度は周期表の右上に行くほど大きく、最も大きいのはフッ素(F)です。
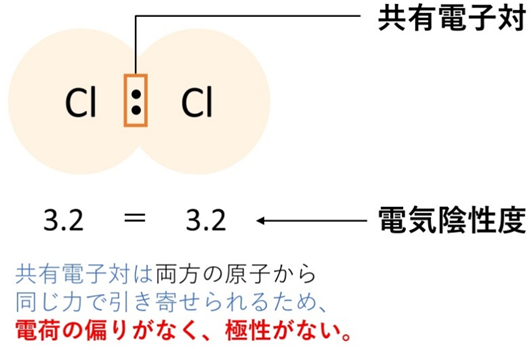
一方、H₂やCl₂のように同じ原子どうしでは電気陰性度が同じで、電子の偏りは生じません。
📘 分子の形が極性を左右する理由
実は、電気陰性度の差があっても、分子の形によって極性が打ち消されることがあります。
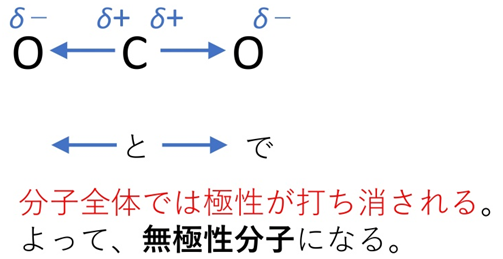
例えばCO₂は、CとOの間には極性がありますが、分子が直線形で対称なため全体では無極性になります。
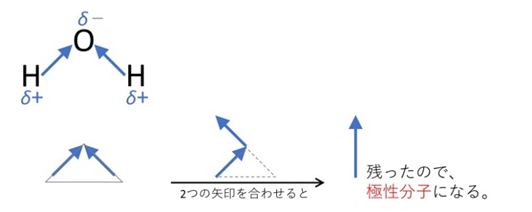
一方、水分子H₂Oは折れ線形なので、2本の結合の極性が打ち消し合わず、極性分子になります。
同じ理由で、NH₃(三角錐形)も極性分子です。
まとめと次のステップ
分子の極性は、
1. 原子間の電気陰性度の差
2. 分子の形による極性の打ち消しの有無
この2つで決まります。
ここまでの理解があれば、HClやH₂O、CO₂の性質をスッと説明できるはずです。
前の単元↓

次の単元↓

さらに詳しく知りたい人は、「電気陰性度と結合の極性」や「分子間力」の解説に進むと、化学の見え方が一気に広がります。
この続きは、電子書籍『一問一答 理論化学1』で、より多くの分子や応用例とともに学べます。あなたの化学の苦手意識が「なるほど!」に変わるはずです。
この記事、どう感じましたか? 感想もらえると嬉しいです(^^)