読んだ後に学びがあったと感じた方は、♡をタップしていただけると嬉しいです。
高校化学で「共有結合結晶」と聞くと、なんだか難しそうな印象がありますよね。でも実は、ダイヤモンドや鉛筆の芯など、私たちの身近な物質にもこの結晶構造が隠れています。今日は、その仕組みと性質をわかりやすく解説します。
目次
共有結合結晶とは?|構造と代表例
非金属元素の原子が共有結合で繰り返し結びつき、広がった構造をもつ結晶を指します。代表例はダイヤモンド、黒鉛(グラファイト)、ケイ素(Si)、二酸化ケイ素(SiO₂)です。化学的に安定で融点が高く、硬いものが多く、水に溶けにくく電気を通しにくい性質を持ちます。
📘 ダイヤモンドの構造と性質
各炭素原子が4つの炭素原子と共有結合し、正四面体構造を形成します。
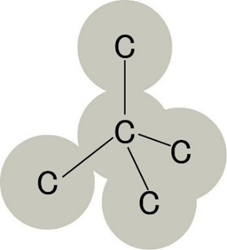
この正四面体が三次元的に連なり、非常に強固な構造を作ります。
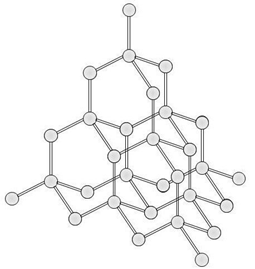
そのため硬さは天然物質の中でもトップクラス。熱伝導性に優れますが、電子はすべて共有結合に使われているため、電気は通しません。
📘 黒鉛(グラファイト)の構造と性質
各炭素原子が3つの炭素原子と共有結合し、六角形の平面構造を作ります。
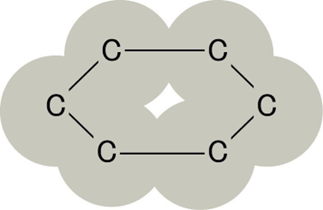
これらの層が弱い分子間力で重なっており、はがれやすく柔らかい性質を持ちます。
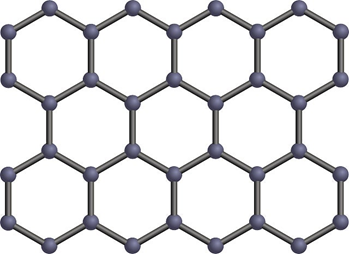
また、価電子の一部が自由電子として動けるため、電気を通します。この性質を活かし、鉛筆の芯や電極材料として利用されます。
まとめと学習のステップアップ
・共有結合結晶は非金属原子が広がった構造を形成
・ダイヤモンド:硬く電気を通さない
・黒鉛:柔らかく電気を通す
同じ炭素でも構造が違えば性質も大きく変わります。「構造と性質の関係」を理解すると化学がより面白くなります。
前の単元↓
あわせて読みたい


【体系解説】分子間力の正体!ファンデルワールス力と水素結合を完全理解
液体や固体の分子は、ただ隣り合っているだけではありません。実は「見えない引力」で引き寄せ合っています。これが分子間力です。今日は、その中でも重要な2種類、「フ…
次の単元↓
あわせて読みたい


【体系解説】金属結晶とは?自由電子がつくる構造と特徴
※本ナレーションはAIによるプロ声優の音声を使用しています。 一部の化学用語に誤読が含まれることがありますが、ご了承ください。 今後、全編を最適化した高品質ナレー…
この記事、どう感じましたか? 感想もらえると嬉しいです(^^)